儘管醫學進展日新月異,但全球仍有95%的罕見疾病(rare diseases)仍處於無藥可醫的狀態。為了照顧罕見疾病患者的需求,除了聚焦特定遺傳性罕見疾病開發藥物的生技公司,也有國際大型藥廠聚焦特定罕見疾病。「孤兒藥」指的是用來治療、預防或診斷罕見疾病的藥品。由於這些疾病影響的人口很少(每一種疾病可能只有幾千人或更少),因此市場回報有限,製藥公司通常缺乏開發動機。為了解決這個問題,政府透過「孤兒藥認定」(Orphan Drug Designation,ODD)給予開發這些藥物的誘因。

圖片來源 : shutterstock、達志影像
孤兒藥認定是由政府機關所提供的特殊法規制度,旨在鼓勵製藥公司研發治療罕見疾病的藥物。以美國為例,藥品若要獲得孤兒藥認定,必須符合疾病影響美國少於20萬人;或是雖然患者超過20 萬人,但藥物無法在沒有政府補助的情況下收回研發成本。生物技術開發中心企劃管考室主任寇怡衡指出,孤兒藥指的是所有適應症均為罕病的藥品,或適應症包括罕病及一般適應症、但罕病適應症的銷售額必須高於總銷售額50%。一旦藥物獲得孤兒藥認定,可能適用於快速審查或優先審查,並可申請政府研究補助,成功開發藥物後,可享有7年市場專屬權,即使專利期已過,美國食品藥物管理局(FDA)也不會批准其他相同適應症的藥物;此外,臨床試驗成本可獲得高達25%的稅收減免。1983年美國《孤兒藥法案》促進全球孤兒藥的發展,至2025年5月底,FDA共授予7,385項孤兒藥認定,其中1,323項獲得上市許可,而近5年核准上市新藥,超過半數具孤兒藥認定資格。
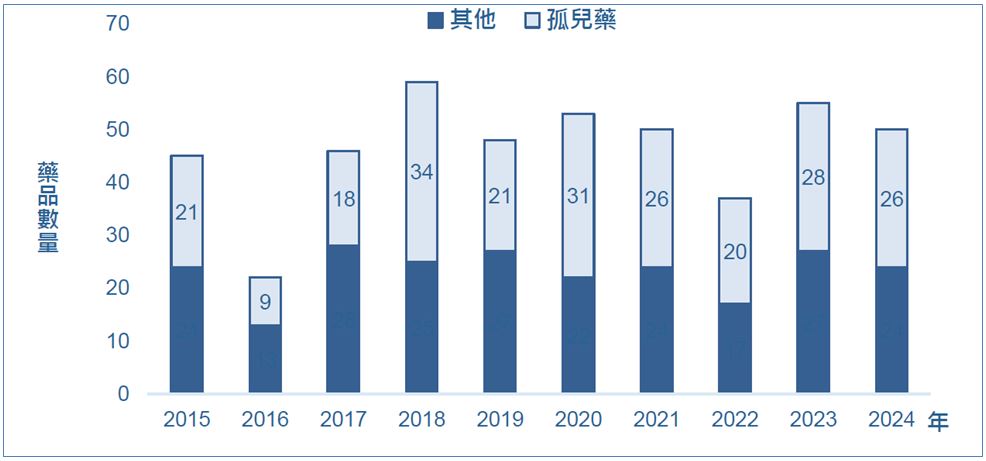
圖1. 2015∼2024年FDA核准的孤兒藥數量;圖片來源:FDA/生技中心整理(2025.01)
不過,罕見疾病仍具有未滿足醫療需求,根據美國罕見疾病組織(National Organization for Rare Disease, NORD)統計,目前已有超過11,000種罕見疾病,目前約有4%∼6%罕見疾病已有至少1種孤兒藥可以治療,亦即仍有95%的罕見疾病仍處於無藥可醫的狀態。
藥廠切入孤兒藥開發之策略
為了照顧罕見疾病患者的需求,有些生技公司會聚焦特定遺傳性罕見疾病,開發治療藥物;也有大型藥廠聚焦特定罕見疾病。寇怡衡舉例,美國藥廠Vertex專注研究囊狀纖維化(CF)、大型醫療保健製造商Johnson & Johnson則以多發性骨髓瘤(MM)為公司重點發展領域,兩家公司所開發的孤兒藥都進入全球孤兒藥銷售前十名。
囊性纖維化是一種罕見的、縮短壽命的遺傳性疾病,目前約有10.9萬人患有囊性纖維化,美國、歐洲、澳洲和加拿大佔全球囊性纖維化人口的絕大多數。隨著囊性纖維化跨膜傳導調節器(CFTR)調節療法的出現,得以解決疾病的根本原因,讓CF的治療發生了巨大變化。
Vertex是一家總部位於美國波士頓的製藥公司,致力於設計、開發治療CF的藥物,至今已獲許可的的五種藥物,適用於約90%的CF患者,有超過 75,000名患者正在接受Vertex藥品的治療。除美國以外,Vertex的CF藥物已銷往六大洲的60多個國家。未來Vertex將為那些因疾病特殊性而無法從現有的CF藥物中受益的剩餘患者,繼續提供先進的治療方法[1]。寇怡衡指出,Vertex聚焦研發治療嚴重疾病的小分子藥物,預測2028年孤兒藥占Vertex整體藥品銷售額高達94%。
除了聚焦於特定罕病精進藥物開發,更多數的大型藥廠是先以罕病加速藥物上市,再擴展至市場較大的適應症,例如美國默克藥廠(Merck)開發的免疫療法抗癌藥品Keytruda,已經被FDA批准用於多種癌症的治療,但2014年是以黑色素瘤首次獲上市許可。寇怡衡進一步解釋,孤兒藥認定的主要價值,在於上市後可獲得市場專屬權的保障(但僅限於獲上市許可的適應症),對於藥廠而言,可利用同一孤兒藥認定下的適應症或擴展應用,以延續市場的專屬權保障。
【本文未完,完整內容請見《北美智權報》386期:BIOMED-X「淘金PITCH競賽」揭榜, 6強新創奪資源加速落地醫療市場】
※如欲轉載本文,請與北美智權報聯絡